
医用电子体温计产品临床试验评价细化要求
医用电子体温计产品 临床试验 评价细化要求根据《关于发布免于进行临床试验的第二类医疗器械目录的通告》(国家食品药品监督管理总局通告2014年第12号)(以下简称《目录》),产品名称:医用电子体温计(不包括预测模式体温计),分类编码:6820包含在免于进行临
医用电子体温计产品临床试验评价细化要求根据《关于发布免于进行临床试验的第二类医疗器械目录的通告》(国家食品药品监督管理总局通告2014年第12号)(以下简称《目录》),“产品名称:医用电子体温计(不包括预测模式体温计),分类编码:6820”包含在免于进行临床试验的第二类医疗器械目录中,申请人需按照《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号附件)及相关的文件要求提交医疗器械临床评价资料。具体要求如下:
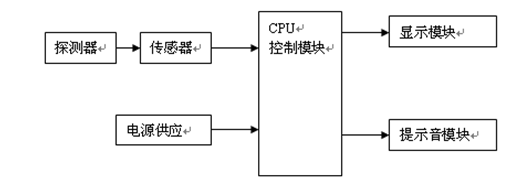
产品结构框图
1.提交申报产品相关信息与《目录》所述内容的比对资料;
2.提交申报产品与《目录》中境内已上市同品种医疗器械的比对说明,进行比对并提供数据的内容应当包括但不限于:预期用途、基本原理、与人体接触部分的制造材料、使用方法、产品结构、测量部位、测量方式、主要技术指标、关键部件(探测器、传感器、CPU控制模块)、其他功能等,并提供相应支持性资料。具体可参见附录1。
3.预测式医用电子体温计可通过同品种医疗器械的对比进行临床评价,也可以按相关法规要求进行临床试验。
医用电子体温计产品临床评价资料编写找鸿远医疗器械咨询为您提供优质的服务!

 在线客服
在线客服