
广东省医疗器械注册收费标准从2017年3月1日起首次注册已上涨到了8.18万元,医疗器械变更注册从原来的免费现要费:3.42万元,医疗器械延续注册收费3.4万元。
最近北京药监局又出新政:
北京市食品药品监督管理局关于发布停征、减免有关行政事业性收费政策的公告( 2017年03月30日发布)
为贯彻落实财政部、国家发展改革委《关于清理规范一批行政事业性收费有关政策的通知》(财税〔2017〕20号)有关精神,根据市财政局、市发展改革委《关于清理规范一批行政事业性收费有关政策的通知》(京财综〔2017〕569号)有关规定,为切实减轻企业和个人负担,现将我局停征及减免有关行政事业性收费政策公告如下:
一、自2017年4月1日起施行停征食品药品监管部门检验费(124003),包括药品检验费(124003001)和医疗器械产品检验费(124003002)。
二、自2017年4月1日起减免部分药品注册费、医疗器械产品注册费。对改变国内药品生产企业名称、国内药品生产企业内部改变药品生产场地(门牌号变更)等不改变药品内在质量的国产药品补充申请常规项,免收药品注册费。对由市食品药品监督管理局负责审批的第二类国产医疗器械产品延续注册事项,免收延续注册费。对国内药品生产企业内部改变药品生产场地(实际生产场地变更)、变更直接接触药品的包装材料或者容器、改变国内生产药品的有效期等需要技术审评的国产药品补充申请事项及国产药品再注册费给予50%的优惠。
特此公告。
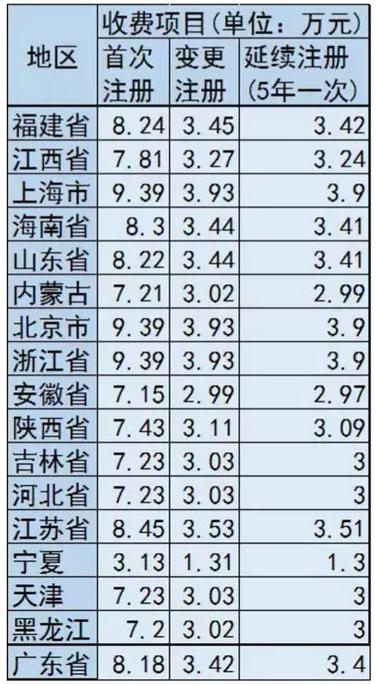
目前全医疗器械注册收费标准情况如下表:
鸿远医疗器械咨询公司 http://www.yixiezixun.com是一家技术专业的医疗器械产品注册证代办理咨询,医疗器械生产许可证代办,医疗器械经营许可证代办,一类医疗器械产品备案代办,二类医疗器械经营备案,CE认证,ISO13485认证,FDA注册/认证,临床试验,医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册,出口证,自由销售证办理,临床试验及免临床资料编写,产品技术要求制订,技术文件编写辅导等提供一站式服务机构,欢迎您咨询与合作!

 在线客服
在线客服