
医疗器械产品注册手术无影灯产品技术审查指导原则编写说明
一、指导原则编写的目的
本指导原则的编写目的是指导和规范注册申请人对手术无影灯医疗器械产品注册资料申报撰写。
二、指导原则编写的依据
(一)《医疗器械监督管理条例》(中华人民共和国国务院令第650号)
(二)《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
(三)关于发布医疗器械注册产品技术要求编写指导原则的通告(国家食品药品监督管理局令第9号)
(四)《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)
(五)免于进行临床试验的第二类医疗器械目录(国家食品药品监督管理总局通告2014年第12号)
(六)《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)
(七)GB 9706.1-2007《医用电气设备 第1部分:安全通用要求》
(八)YY 0627-2008《医用电气设备 第2部分:手术无影灯和诊断用照明灯安全专用要求》
三、指导原则中重点内容的编写说明
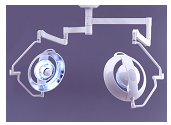
(一)本指导原则根据安装使用方式将手术无影灯分为固定式、移动式,简单介绍了手术无影灯的工作原理,并给出了手术无影灯典型产品的结构示意图。
(二)因产品为非治疗类医疗器械,故本指导原则不包含产品作用机理的内容。
(三)产品应适用的相关标准中给出了现行有效的国家标准、行业标准。
(四)依据相关标准并参考已注册产品情况,给出了产品技术要求应包括的主要性能指标。
(五)医疗器械注册产品的主要风险中,参照YY/T 0316-2008及其附录C、E、F、G、I、J中的相关规定,对手术无影灯的安全性特征,危害、可预见的事件序列和危害处境判断,风险控制的方案与实施,综合剩余风险的可接受性评价及生产和生产后监视相关方法等方面提出了审查基本要求;同时,对手术无影灯的危害、可预见的事件序列和危害判断进行了系统分析。
(六)给出了产品研究、生产制造及检验要求。
鸿远医疗器械咨询公司 http://www.yixiezixun.com是一家技术专业的医疗器械产品注册证代办理咨询,医疗器械生产许可证代办,医疗器械经营许可证代办,一类医疗器械产品备案代办,二类医疗器械经营备案,CE认证,ISO13485认证,FDA注册/认证,临床试验,医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册,出口证,自由销售证办理,临床试验及免临床资料编写,产品技术要求制订,技术文件编写辅导等提供一站式服务机构,欢迎您咨询与合作!

 在线客服
在线客服