
医疗器械咨询2023年广西自治区第二类医疗器械注册证核发申请需要哪些材料?广西自治区第二类医疗器械注册证核发怎么办理?依据《医疗器械监督管理条例》 (国务院令第739号),申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。
《医疗器械监督管理条例》 (国务院令第739号)第十五条 第一类医疗器械产品备案,由备案人向所在地设区的市级人民政府负责药品监督管理的部门提交备案资料。向我国境内出口第一类医疗器械的境外备案人,由其指定的我国境内企业法人向国务院药品监督管理部门提交备案资料和备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。未在境外上市的创新医疗器械,可以不提交备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。 备案人向负责药品监督管理的部门提交符合本条例规定的备案资料后即完成备案。负责药品监督管理的部门应当自收到备案资料之日起5个工作日内,通过国务院药品监督管理部门在线政务服务平台向社会公布备案有关信息。 备案资料载明的事项发生变化的,应当向原备案部门变更备案。第十六条 申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府药品监督管理部门提交注册申请资料。申请第三类医疗器械产品注册,注册医疗器械申请人应当向国务院药品监督管理部门提交注册申请资料。向我国境内出口第二类、第三类医疗器械的境外注册申请人,由其指定的我国境内企业法人向国务院药品监督管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。未在境外上市的创新医疗器械,可以不提交注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。 国务院药品监督管理部门应当对医疗器械注册审查程序和要求作出规定,并加强对省、自治区、直辖市人民政府药品监督管理部门注册审查工作的监督指导。
2023年广西自治区第二类医疗器械注册证核发申请受理条件如下:
1、医疗器械注册、备案应当遵守相关法律、法规、规章、强制性标准,遵循医疗器械安全和性能基本原则,参照相关技术指导原则,证明注册、备案的医疗器械安全、有效、质量可控,保证
2、申请人、备案人应当为能够承担相应法律责任的企业或者研制机构。
境外申请人、备案人应当指定中国境内的企业法人作为代理人,办理相关医疗器械注册、备案事项。代理人应当依法协助注册人、备案人履行《医疗器械监督管理条例》第二十条第一款规定的义务,并协助境外注册人、备案人落实相应法律责任。
3、申请人、备案人应当建立与产品相适应的质量管理体系,并保持有效运行。
4、办理医疗器械注册、备案事项的人员应当具有相应的专业知识,熟悉医疗器械注册、备案管理的法律、法规、规章和注册管理相关规定。
广西自治区第二类医疗器械注册证办理流程图:
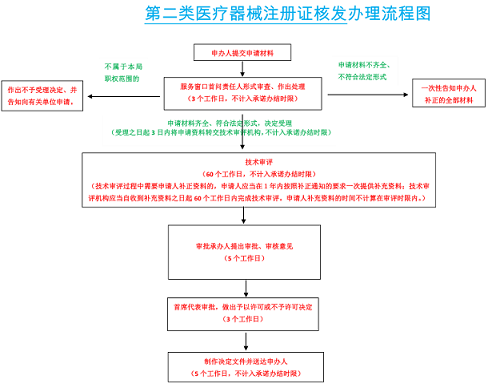
二类医疗器械注册证办理申请材料:
1、申请表
2、术语、缩写词列表
3、产品列表
4、关联文件
5、申报前与监管机构的联系情况和沟通记录
6、符合性声明
7、概述
8、产品描述
9、适用范围和禁忌证
10、申报产品上市历史
11、产品风险管理资料
12、医疗器械安全和性能基本原则清单
13、产品技术要求及产品检验报告
14、研究资料
15、非临床文献
16、稳定性研究
17、临床评价资料要求
18、产品说明书
19、标签样稿
20、生产制造信息
21、质量管理体系程序
22、管理职责程序
23、资源管理程序
24、产品实现程序
25、质量管理体系的测量、分析和改进程序
26、质量管理体系核查文件
《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2021年第121号)》附件5(医疗器械注册申报资料要求及说明)
广西第二类医疗器械产品首次注册:30280元/次。
深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、广西、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证、医疗器械生产许可证、进口医疗器械注册、一类医疗器械产品备案及生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、医疗器械分类界定、CE认证、ISO13485认证、FDA注册、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品比对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理、洁净室建设指导等提供一站式服务,技术专业,诚信服务,欢迎您咨询。

 在线客服
在线客服