
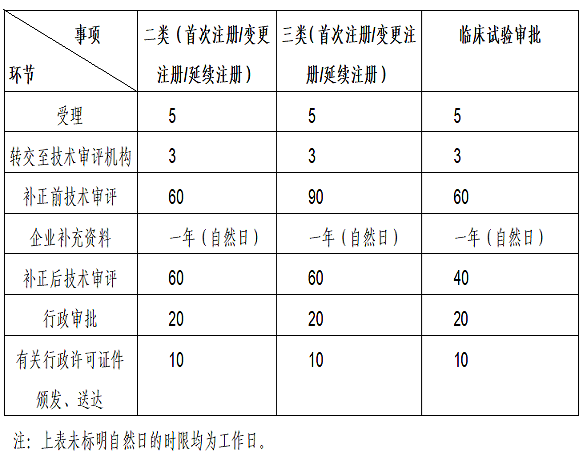
医疗器械注册代理根据《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)和《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)中有关工作时限要求,审评相关各环节法定时限详见下表:
根据器审中心统计数据,2022年器审中心的审评工作总体用时按管理类别看,二类医疗器械产品注册审评总体平均用时为72个工作日,三类产品注册为99个工作日;按申请事项看,产品首次注册审评总体平均用时为95个工作日,变更注册为64个工作日,延续注册为39个工作日。以上用时为当前统计平均用时,供大家参考。
需注意的是,以下时间不计入上述相关工作时限:
(一)医疗器械注册申请人补充资料、核查后整改等所占用的时间;
(二)因申请人原因延迟核查的时间;
(三)外聘专家咨询、召开专家咨询会、药械组合产品需要与药品审评机构联合审评的时间;
(四)根据规定中止审评审批程序的,中止审评审批程序期间所占用的时间;
(五)质量管理体系核查所占用的时间。
鸿远医疗器械咨询服务公司是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、广西、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、体外诊断试剂注册、进口医疗器械注册、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立( ISO13485, GMP, CE,QSR820,CMDCAS);注册、医疗器械出口销售证明、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、医疗器械广告批文申报、电磁兼容整改等提供一站式服务公司,老师微信及手机号:13590396780欢迎您咨询与合作!

 在线客服
在线客服