
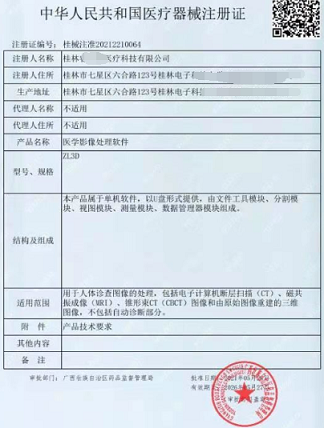
独立医疗器械软件产品注册技术要求模板
2022年独立 医疗器械软件产品注册 技术要求模板 医疗器械产品技术要求 医疗器械产品技术要求编号: 产品名称 1. 产品型号/规格及其划分说明 1.1 软件型号规格 明确软件的型号/规格,无需体现软件发布版本。 1.2 软件发布版本 明确软件发布版本,若软件模块(
2022年独立医疗器械软件产品注册技术要求模板
医疗器械产品技术要求
医疗器械产品技术要求编号:
产品名称
1. 产品型号/规格及其划分说明1.1 软件型号规格
明确软件的型号/规格,无需体现软件发布版本。
1.2 软件发布版本
明确软件发布版本,若软件模块(含医用中间件)单独进行版本控制亦需提供其发布版本。
1.3 软件版本命名规则
明确软件完整版本全部字段的位数、范围、含义,若软件模块(含医用中间件)单独进行版本控制亦需提供其版本命名规则,并明确与软件版本命名规则的关系。软件和软件模块的版本命名规则均需与质量管理体系保持一致。
2. 性能指标
2.1 通用要求
2.1.1 功能
依据说明书和用户界面明确软件供用户调用的全部功能(含安全功能)纲要,注明选装、自动功能,其中客观物理测量功能明确测量准确性指标,数据资源(如参考数据库)明确数据种类和每类数据的样本量。若核心功能相同但核心算法类型不同,则每类核心算法均需备注。
2.1.2 使用限制
依据说明书明确软件的用户使用限制和技术限制。
2.1.3 输入输出
明确软件的输入数据类型(如医学图像、生理参数、体外诊断等数据)、输出结果类型(如处理、测量、分析等结果)。
2.1.4 接口
明确软件供用户调用的应用程序接口(API)、数据接口(含传输协议、存储格式,如DICOM、HL7、JPG、PNG、私有协议与格式)、产品接口(可联合使用的其他医疗器械独立软件、医疗器械硬件产品)。
2.1.5 必备软硬件
明确软件正常运行所必需的其他的医疗器械独立软件(名称、型号规格、发布版本)及医用中间件(名称、型号规格、发布版本)、医疗器械硬件产品(名称、型号规格)。
2.1.6 运行环境
明确软件正常运行所需的典型运行环境,包括硬件配置(含处理器、存储器、外设器件)、外部软件环境(列明全部软件的名称、完整版本、补丁版本,使用“兼容版本”而非“以上版本”、“更高版本”)、网络条件(含网络架构、网络类型、网络带宽),涵盖客户端、服务器端(若适用)、云端(若适用)要求。无需重复描述必备软硬件。
2.1.7 性能效率
明确软件在典型运行环境(含云计算)下完成典型核心功能的时间特性,若适用明确资源利用性、容量。
2.1.8 最大并发数
明确软件在典型运行环境(含云计算)下的实施典型并发操作的最大并发用户数和/或患者数,注明相应响应时间。
2.1.9 用户界面
明确软件的用户界面类型和用户输入类型。
2.1.10 消息
明确软件向用户提供的消息类型和形式。
2.1.11用户差错防御
明确软件对导致严重后果的用户操作错误的防御能力。
2.1.12 访问控制
明确软件的用户身份鉴别方法、用户类型及用户访问权限。
2.1.13 版权保护
明确软件的版权保护技术及其对软件正常使用的影响。
2.1.14 可靠性
明确软件出错的数据保存、恢复及继续运行能力。
2.1.15 维护性
明确软件向用户提供的维护功能和维护信息类型。
2.2 专用要求 (若适用)
注:依据专用标准(名称、发布年份)适用条款逐条描述
2.2.1 YY 0775-2010(若适用)
2.2.2 YY/T 0887-2013(若适用)
2.2.3 YY/T 0889-2013(若适用)
2.2.4 YY/T 0973-2016(若适用)
……
2.3 安全要求 (若适用)
注:明确安全标准名称和发布年份
2.3.1 YY 0709-2009(若适用)
2.3.2 YY 0637-2013(若适用)
2.3.3 YY 0721-2009(若适用)
……
3. 检验方法
3.0 依据检测单元分述软件测试环境(与典型运行环境等同)。
3.1 通用要求符合性检验
通过检查说明书、实际操作、软件测试等方法逐条说明2.1各条款的检验方法,并验证2.1各条款的符合性。
若核心功能相同但核心算法类型不同,则每类核心算法所对应的核心功能均需检测(检测对象为核心功能而非核心算法)。
3.2 专用要求检验方法(若适用)
3.2.1依据YY 0775-2010的方法进行检验(若适用)。
3.2.2依据YY/T 0887-2013的方法进行检验(若适用)。
3.2.3依据YY/T 0889-2013的方法进行检验(若适用)。
3.2.4依据YY/T 0973-2016的方法进行检验(若适用)。
……
3.3 安全要求检验方法(若适用)
3.3.1 依据YY 0709-2009的方法进行检验(若适用)。
3.3.2 依据YY 0637-2013的方法进行检验(若适用)。
3.3.3 依据YY 0721-2009的方法进行检验(若适用)。
……
4. 术语(若适用)
注:明确软件所用专业术语(缩写)含义
4.1 ……
4.2 ……
4.3 ……
……
(分页)
附录
注:图示均需提供必要注释
1.体系结构图
2.用户界面关系图与主界面图示
3.物理拓扑图
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、广西、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、体外诊断试剂注册、进口医疗器械注册、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立( ISO13485, GMP, CE,QSR820,CMDCAS);注册、医疗器械出口销售证明、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、医疗器械广告批文申报、电磁兼容整改等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服