
医疗器械注册肺通气功能测试产品工作原理/作用机理:
在综述资料中,注册申请人应在产品描述部分明确产品的工作原理和流量传感器的测量原理。
工作原理:
产品通过流量传感器,测量患者呼出或吸入的气体的流量及容量,根据时间-容积曲线和流量-容积曲线,分析得出人体呼吸生理的肺通气指标,如慢肺活量、最大自主通气量及用力肺活量等参数。按物理学定律,设某一瞬间的流体流量为Q,一定时间t内流过的流体的体积为V,则V=∫Qdt 或Q=dV/dt;而由流经截面积A的流体流量Q及吸/呼气体时间t可求出吸/呼气容量V。
医疗器械产品注册目前常见的流量传感器测量原理如下:
压差式:利用在一定阻力的流通管道中气流的压力P变化与流量的依从关系测定流量R=ΔP/ΔQ。压差式流量传感器包括两部分:已知阻力或阻力曲线的流量压力变换器:实现气体流量与压差的一次变换,根据流经该变换器的气体流量大小不同,变换器两端敏感处相应的压力差,即压差信号产生相应变化。压差传感器:将与流量成一定比例关系的压差信号转换成一定的电信号,经处理后以数字或曲线图形显示。
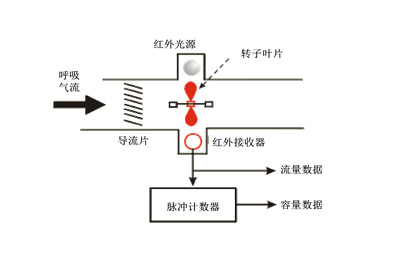
涡轮式:依据转动部件涡轮的转动速度与流体速度成正比的特性进行测量。气流通过时推动涡轮转动,涡轮式采用磁电调制或光电调制原理,把涡轮的机械转动信号转换成电信号输出。
热线式:依据热量传导与气体流量相关的原理设计。核心部分为温度依赖性电阻元件,热线或热珠接通电源时该元件加温,当气流通过热敏件时可使其温度下降,并改变电阻,从而引起维持热线温度的补偿电流变化。维持热线温度的电流的变化与气体流速成正比。
医疗器械注册代办产品的结构和组成:
肺通气功能测试产品通常由主机、流量传感器和附件(如一次性使用呼吸过滤器、鼻夹、咬嘴等)组成。
产品适用的相关医疗器械注册标准
目前与肺通气功能测试产品相关的国家标准及行业标准列举如下:
| GB/T 191—2008 | 包装储运图示标志 |
| GB 9706.1—2007 | 医用电气设备第一部分:安全通用要求 |
| GB/T 14710—2009 | 医用电器设备环境要求及试验方法 |
| GB/T 16886.1—2011 | 医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
| GB/T 16886.5—2017 | 医疗器械生物学评价第5部分:体外细胞毒性试验 |
| GB/T 16886.10—2017 | 医疗器械生物学评价第10部分:刺激与皮肤致敏试验 |
| GB/T 16886.12—2017 | 医疗器械生物学评价 第12部分:样品制备与参照材料 |
| YY/T 0316—2016 | 医疗器械风险管理对医疗器械的应用 |
| YY/T 0466.1—2016 | 医用器械用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求 |
| YY 0505—2012 | 医用电气设备第1—2部分:安全通用要求并列标准:电磁兼容要求和试验 |
| YY/T 1438—2016 | 麻醉和呼吸设备评价自主呼吸者肺功能的呼气峰值流量计 |
产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是在编写产品技术要求时与产品相关的国家标准、行业标准是否进行了引用,以及引用是否准确。可以通过对企业提交的符合性声明判断是否引用了相关标准,以及所引用的标准是否适宜。此时,应注意标准编号、标准名称是否完整规范,标准是否现行有效。其次对引用标准的采纳情况进行审查。即所引用的标准中的条款要求,是否在产品技术要求中进行了实质性的条款引用。这种引用通常采用两种方式,文字表述繁多、内容复杂的可以直接引用标准及条文号。比较简单的也可以直接引述具体要求。
医疗器械注册办理如有新版强制性国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行业标准。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、体外诊断试剂注册、进口医疗器械注册、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立( ISO13485, GMP, CE,QSR820,CMDCAS);注册、医疗器械出口销售证明、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、医疗器械广告批文申报、电磁兼容整改等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服