
医疗器械注册热敷贴(袋)产品名称要求,在《关于发布医疗器械分类目录的公告》(国家食品药品监督管理总局公告2017年第104号)中,热敷贴(袋)的管理类别为二类,产品分类编码为09-02-01。产品名称应为通用名称,并符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)等相关法规、规范性文件的要求。核心词为“热敷贴(袋)”,特征词1产品作用方式(指产品与人体接触方式),如直接接触皮肤产品为接触式,不直接接触皮肤产品为非接触式等,特征词2产品结构特点(产品主体结构方面的特有属性),如粘贴式和非粘贴式等;特征词3按产品使用部位(指产品发挥其主要功能的患者部位),如关节和颈椎等。
医疗器械产品注册产品的结构和组成:
热敷贴(袋)是一种外用敷贴,为局部使用产品,铁粉与空气中的氧气发生氧化反应致热的发热产品,一般为一次性使用。按使用方式可分为粘贴式和非粘贴式,按与人体接触方式可分为直接接触皮肤式和非直接接触皮肤式。
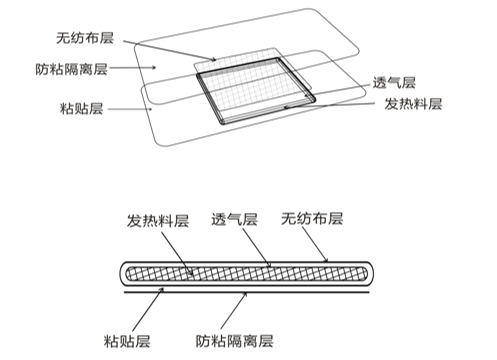
热敷贴(袋)一般由无纺布层(或其他医用材料)、透气层、发热料层(以铁粉、水、活性炭、食盐等为原料)、粘贴层(医用胶带/压敏胶层)和防粘隔离层(硅油纸、离型纸/膜)及外袋组成。
1.外袋
热敷贴(袋)由于其发热原理,在贮存时需隔绝空气,因此,需要具有密封性能的外包装袋或外包装真空袋来保证包装的气密性,即阻隔空气中的氧气,防止发热包中水分蒸发。
2.无纺布层
热敷贴(袋)放热过程中控制放热时间和温度是通过透气膜透氧率进行控制的,而透气膜较薄、易破损,覆盖一层无纺布可以防止透气膜磨损,又因其柔软特性,使用时舒适度较高。
3.透气层
医疗器械注册代办热敷贴(袋)放热过程中控制温度和放热时间是通过透气膜透氧率进行控制的。如果透氧率过高,发热包释放的热量比较集中,会导致温度过高而烫伤皮肤,且持续放热时间较短。如果透氧率过低,会导致温度过低,无法达到辅助治疗目的。
4.发热料层
以铁粉、水、活性炭、食盐等原料混合而成,是热敷贴的核心组成部分。其发热时间和发热温度除与氧气透过率有关,还与该发热料层的原料配比有关。另外铁粉的纯度及粗细都会直接影响温度特性。
5.粘贴层
使热敷贴(袋)可以直接固定于皮肤或者衣物上。一般由压敏胶和背衬组成,常用医用胶带。
6.防粘隔离层
使热敷贴(袋)在使用前保持粘性,方便使用。
以上列举了热敷贴(袋)的一般结构组成,部分产品发热料层中含有保温材料(如蛭石),保水材料(如吸水树脂)等,部分产品含有缓释热垫,申请人应详述各组成部分的材料。产品内袋一般由无纺布层、透气层和粘贴层组成,申请人应明确内袋、外袋和粘贴层的材质和物理尺寸,必要时,可配示意图。申报时需提供产品各组成部分的清晰图片。
医疗器械热敷贴(袋)产品注册研究资料要求:
1.产品性能研究
应给出技术要求(包括规格参数和性能要求)中各性能指标的设定依据、所采用的标准或方法、采用的原因及理论基础。
热敷贴(袋)的性能研究可参照YY 0060—2018《热敷贴(袋)》。若适用的国家标准、行业标准中有不采纳或偏离的条款,应说明不适用的理由。
2.生物相容性评价
与人体直接接触的,应按照《关于印发医疗器械生物学评价和审查指南的通知》(国食药监械〔2007〕345号)提交生物学评价报告。
医疗器械注册代理生物相容性评价应根据预期用途明确热敷贴(袋)预期与人体接触的部位、接触性质、接触时间以及所采用的材料的种类。根据接触性质、接触时间、材料的种类等信息选择合适的评价方式开展评价研究。
如需进行生物相容性试验,应按照GB/T 16886系列标准的要求开展。并注意:
(1)生物相容性评价应对成品中预期与人体接触的部分进行评价。
(2)研究资料中的生物学试验报告可提供境内检验报告或境外检验报告,检验报告中应包括样品制备方法、试验方法及试验结果。境外报告需提供国外实验室表明其符合GLP实验室要求的质量保证文件。
3.灭菌/消毒工艺研究
热敷贴(袋)通常为一次性使用非无菌提供的产品,不涉及灭菌/消毒工艺。
4.医疗器械注册办理产品有效期和包装研究
热敷贴(袋)产品应提供有效期验证报告。热敷贴(袋)类产品有效期属于货架有效期,验证类型通常可分为加速稳定性试验或实时稳定性试验两类,试验后产品的使用性能仍符合产品技术要求。
热敷贴(袋)的包装应该能够保护其免受不利的储存和运输条件影响所造成的损害。对于热敷贴(袋)类产品,主要是从发热材料和封装材料的保护角度出发,目的是保障其使用性能。应提供包装的信息,包括不限于包装材料、包装尺寸、包装方式、包装封口工艺等,可通过图示说明。
医疗器械产品注册办理包装及包装完整性:产品包装应进行完整性测试,并提供运输过程和存储环境对产品产生影响的验证资料。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、体外诊断试剂注册、进口医疗器械注册、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立( ISO13485, GMP, CE,QSR820,CMDCAS);注册、医疗器械出口销售证明、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、医疗器械广告批文申报、电磁兼容整改等提供一站式服务公司,欢迎您咨询与合作

 在线客服
在线客服