
医疗器械注册一次性使用手术衣产品注册的主要技术指标,一次性使用手术衣产品需要评价的性能要求,其中部分性能要求给出了定量要求,其他性能要求企业可参考相应的国家标准、行业标准,根据企业自身产品的技术特点制定相应的要求,但不得低于相关强制性国家标准、行业标准的有关要求。如有不适用条款(包括国家标准、行业标准要求),企业在标准的编制说明中必须说明理由。
1.规格尺寸
医疗器械产品注册企业应明确指出申报产品所包含的规格尺寸和允差要求。
2.YY/T0506-2009《病人、医护人员和器械用手术单、手术衣和洁净服》中性能要求见下表:
| 性能名称 | 单位 | 要求 | ||||
| 标准性能 | 高性能 | |||||
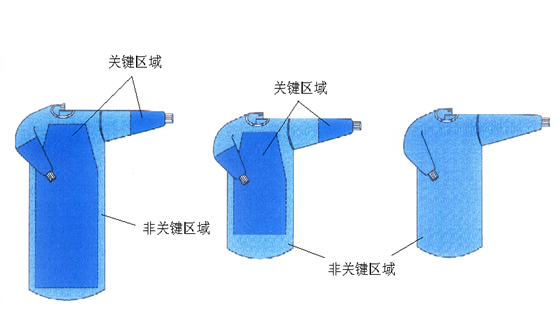
| 产品关键区域 | 产品非关键区域 | 产品关键区域 | 产品非关键区域 | |||
| 阻微生物穿透,干态 |
Log10 CFU |
不要求 | ≤2a,c | 不要求 | ≤2a,c | |
| 阻微生物穿透,湿态 | IB | ≥2.8b | 不要求 | 6.0b,d | 不要求 | |
| 洁净度,微生物 | Log10(cfu/dm2) | ≤2c | ≤2c | ≤2c | ≤2c | |
| 洁净度,微粒物质 | IPM | ≤3.5 | ≤3.5 | ≤3.5 | ≤3.5 | |
| 落絮 | Log10(落絮计数) | ≤4.0 | ≤4.0 | ≤4.0 | ≤4.0 | |
| 抗渗水性 | cmH2O | ≥20 | ≥10 | ≥100 | ≥10 | |
| 胀破强度,干态 | kPa | ≥40 | ≥40 | ≥40 | ≥40 | |
| 胀破强度,湿态 | kPa | ≥40 | 不要求 | ≥40 | 不要求 | |
| 拉伸强度,干态 | N | ≥20 | ≥20 | ≥20 | ≥20 | |
| 拉伸强度,湿态 | N | ≥20 | 不要求 | ≥20 | 不要求 | |
b用YY/T0506.6试验时,在95%的置信水平处的IB的最小显著性差异为0.98。这是区分两个材料之间有所不同的最小差异。小于等于0.98IB的材料变动可能无差异;而大于0.98IB则可能有差异(95%的置信水平意味着进行20次试验,至少有19次是正确的)。
c在本部分中log10(CFU≤2)意味着最大300CFU。
d本部分中IB=6.0时,意味着无穿透。IB=6.0是最大可接受值。
3.医疗器械产品注册代理其它性能指标
(1)粘合或缝制要求
粘合或缝制部位的性能应符合标准要求。
(2)无菌要求
一次性使用手术衣应无菌供应,应经过一个确认过的灭菌过程使其无菌。
(3)化学性能要求
一次性使用手术衣若采用环氧乙烷灭菌,环氧乙烷残留量应不大于 10 mg/kg。
(4)生物性能要求
一次性使用手术衣对皮肤应无刺激与迟发型超敏反应。
(5)结构要求
如有系带应规定系带长度、系带固定的牢固度等。
4.医疗器械注册代办一次性使用手术衣的透气性对产品的使用和手术质量的保证非常重要,考虑到目前对产品的透气性指标提出一个统一要求的依据不够充分,制造商应结合临床具体应用对产品的透气性进行评价,并对各区域标示透气性指标。
产品的检验要求
产品的检验包括出厂检验和型式检验。
出厂检验应至少包括环氧乙烷残留量(若采用环氧乙烷灭菌)、无菌。
医疗器械注册办理型式检验报告是证实生产过程有效性的文件之一。注册申请时进行的型式检验应由具备合法资质的检验机构进行。型式检验时,若标准中无特殊规定,按相应的标准要求进行全性能检验,应全部合格。
医疗器械产品注册一次性使用手术衣产品的临床要求
一次性使用手术衣产品设计定型、工艺成熟,临床应用多年,不改变常规用途,且无严重不良事件记录,通过非临床评价、注册检验及质量体系考核能够保证产品的安全性、有效性,故原则上不要求临床试验。
鸿远医疗器械咨询服务公司是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服