
医疗器械注册证申请吻(缝)合器产品《医疗器械分类目录》中按照第二类医疗器械管理的吻合器。目前临床使用的具备“机械吻合”性能的器械种类繁多,本指导原则只收纳了产品设计(材料、结构)、生产工艺、技术性能和预期用途已相对成熟的“管型吻合器(含肛肠吻合器)、直线型吻合器、直线型切割吻合器和弧线型吻合器”产品。其他具备吻合功能的产品在设计、功能与预期用途方面与上述产品差异较大,有些产品甚至处于临床早期应用阶段,如皮肤缝合器、腔镜下使用吻合器未收录在本指导原则内。
吻合器产品名称要求:
医疗器械产品注册证申请吻合器名称应符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)的要求,可采用相关国家标准、行业标准上的通用名称,或以产品结构和适用范围为依据命名。一般情况下,按照是否重复使用将吻合器分为重复使用和一次性使用两类,两类吻合器的结构和功能基本相同。重复使用吻合器又包括完全重复使用和仅吻合器器身重复使用两种。前者目前已退出市场,后者将吻合器控制击发部分(即器身)设计为可重复使用,用不锈钢等材料制成,可高温高压灭菌,同时配有一定数量的一次性使用组件,而器身经重复灭菌,在其他病人中继续应用。这种组合使一台手术中一把吻合器使用多个吻合组件成为现实,大大降低了手术成本。
医疗器械注册证办理通常情况下,吻合器按照吻合后钉的排列形状和是否带有切割功能来命名。可重复使用的产品通用名称为“管型吻合器”“直线型吻合器”“直线型切割吻合器”和“弧线型切割吻合器”等。而预期一次性使用产品应带有“一次性使用”等字样。如“一次性使用管型吻合器” “一次性使用直线型吻合器” “一次性使用直线型切割吻合器” “一次性使用弧线型切割吻合器”等。其中管型吻合器又按照用途不同分为管型吻合器(消化道)和肛肠吻合器(或称为痔吻合器)。
常见的产品名称举例:
一次性使用吻合器:
一次性使用管型消化道吻合器及组件
一次性使用直线型吻合器及组件
一次性使用弧线型吻合器及组件
一次性使用直线型切割吻合器及组件
一次性肛肠吻合器及组件
重复使用的吻合器:
管型吻合器或管型吻合器及组件
直线型吻合器或直线型吻合器及组件
直线型切割吻合器或直线型切割吻合器及组件
肛肠吻合器及组件
产品的结构和组成
1.产品的结构和组成
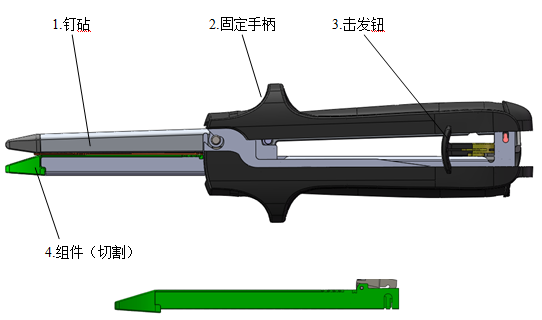
医疗器械产品注册证办理通常情况下每一副完整的吻合器最基础的组成是钉砧、器身和组件。钉砧又名抵钉座。组件是对吻合器中可更换部分的总称,通常包括钉仓、推钉片和吻合钉。具备切割功能的组件通常称为吻切组件。不具备切割功能的吻合器组件习惯称为吻合组件。在本指导原则中统一称为“组件”。
在此基础上为了实现特定的功能或者增加器械的安全有效性,申请人会增加一些其他组成。如用来固定被吻合组织的定位针,用来防止二次击发的保险机构以及调节旋钮等等。以下将分别介绍。
2.典型吻合器产品结构示意图
(1)一次性使用管型(消化道)吻合器
(2)一次性使用直线型吻合器及组件
(3)一次性使用直线型切割吻合器及组件
(4)一次性使用弧线型切割吻合器和组件
吻合器产品工作原理/作用机理
医疗器械注册证代办吻合器工作原理与订书机相似,故其总称为Stapler。吻合器通过机械传动装置将预先放置在组件中,呈两排或数排互相平行错位排列的吻合钉击入已经对合好、需要吻合在一起的组织内,吻合钉在穿过两层组织后受到前方钉砧槽的阻挡,向内弯曲,形成类“B”形互相错位排列,将两层组织永久性钉合在一起。由于毛细血管可以从类“B”形缝钉的空隙中通过,故不影响缝合部位及其远端的血液供应,这种钉合可以实现稳定的,张弛合理的,益于被吻合组织愈合的效果。
吻合钉应采用符合生物兼容性(植入)的材料制造(如:钛)要求。由于吻合钉排列整齐,间距相等,缝合松紧度由标尺控制或有预定控制,避免了手工缝合过疏过密和结扎过紧过松等缺陷,既保证了组织良好的愈合,同时也大大缩短了手术时间。
各种吻合器为达到类“B”型缝钉的缝合,设计的主要部件有钉钻、组件、击发手柄,定位针,旋钮及标记尺等。为了切除吻合后多余组织,满足临床对吻合口及吻合效果的要求,还装备了各种刀具,如环形刀,推刀等。这些部件按一定的操作规程使用,保证组织缝合或吻合口的迅速、准确地完成。具体部件将在各类吻合器中介绍。
1.管型吻合器
管型消化道吻合器(简称为管型吻合器):此类型的吻合器是为管腔组织吻合而设计。按钉砧与器械体是否可分离分为分体式和连体式两类。按照是否可以调节吻合厚度分为可调节和不可调节两种型式,按照外形可分为弯管型和直管型两种形式。手术操作时,分别将待吻合的管腔组织两端套入并收紧荷包固定于钉砧和器械体上。再将钉砧与器械体对合连接,可调节型调节吻合器末端调节旋钮,将吻合器钉砧和器械体之间收紧至可击发区域或预定位置,然后进行击发即完成吻合,同时切除管腔内多余的组织,吻合完成后退出器械。
医疗器械注册证代理管型吻合器主要用于消化道重建手术中的吻合口的创建。根据临床医生依照解剖学原理,一般将管身设计为直型和弯型两种类型。其中以弯型最常用,并按吻合器钉砧直径不同划分为若干规格,不同直径的管腔组织可选择不同的规格。
肛肠吻合器:是管型吻合器的一种,此类吻合器专为肛肠手术设计,原理上与管型吻合器基本相同,在使用过程中需要与组件包配套使用。
使用该类吻合器进行的手术又称为PPH(Procedure for Prolapsed and Hemorrhoids),即:痔上黏膜与黏膜下层切除术
2.直线型吻合器
医疗器械产品注册证代理这种吻合器根据闭合间隙是否可调分为固定间隙和可调间隙两种型式。这种吻合器可将组织进行直线型缝合。将组织放在组件和钉砧之间,安置好定位针,根据组织厚度标尺设定好适合的厚度,扳动击发手柄,缝钉驱动器即将两排平行错位的缝钉植入组织并弯曲成类“B”形,和订书机原理一样,牢固地将两层组织钉合封闭。这种吻合器无切割功能,在松开吻合器前,须沿缝合器边缘,切除多余组织。
这种吻合器的组件可以更换,并设计有防止二次击发和误击发装置。吻合后钉的排列形状通常呈直线形,适用于消化道重建和脏器切除手术中的残端或切口的关闭。因需要闭合组织的宽度和厚度不同,设计了多种规格长度、厚度的器械和组件供临床选用,同一台手术,一把直线型吻合器可更换多个长度一致组件。为配合临床合理机动使用,组件可做单独无菌包装。
3.直线型切割吻合器
直线型切割吻合器根据切割刀的装配位置分为器身带刀和组件带刀两种型式。产品设计了可以同时在组织的两侧各击入数排(常见的为两排)直线、平行错位排列的缝钉,用以钉合组织。使用时,将手柄压下两层组织进行固定以后,推动击发钮,向前方推进,推进过程中推刀在两侧已缝合好的组织之间进行切割离断。平行的吻合钉相互错位排列,可以很好地防止出血和渗漏。目前临床广泛应用于消化道重建及脏器切除手术中的吻合口创建和残端或切口的关闭,是一种同时能完成吻合与闭合二大功能的器械。同一台手术一把直线型切割吻合器可更换多个长度一致的组件。为配合临床合理机动使用,组件可做单独无菌包装。
4.弧线型切割吻合器
医疗器械产品注册证代办弧线型切割吻合器是在直线型吻合器和管型吻合器基础上设计开发出来的,弥补了手术视野暴露困难时,直线型切割吻合器无法顺利操作的缺陷。弧线型切割吻合器组件可以置换。同一台手术一把弧线型切割吻合器可更换多个组件。为配合临床合理机动使用,组件可做单独无菌包装。
弧线型切割吻合器临床用于消化道重建和脏器切除手术中的残端或切口的关闭,该器械由于特别的弧形头设计,特别适用于盆腔底部手术暴露困难的部位。
医疗器械吻合器产品的研究资料要求:
1.产品性能研究
办理医疗器械注册证应提交产品性能的研究资料以及产品技术要求的研究和编制说明,主要包括产品技术要求内容和说明书中所宣称的物理性能、化学性能、生物性能以及与质量控制相关的其他方面的指标要求、采用标准及试验方法的理论基础或实施依据。产品的性能要求及试验方法可参考YY/T 0245—2008《吻(缝)合器 通用技术条件》、YY 0875—2013《直线型吻合器及组件》、YY 0876—2013《直线型切割吻合器及组件》中的适用部分进行制定。
若产品带有配合使用的附件,应分别列出附件的材料、尺寸、性能要求。
2.生物相容性评价研究
对吻合器中与人体接触的部件,如抵钉座、钉仓等应按照GB/T 16886《医疗器械生物学评价》系列标准对吻合器进行生物相容性评价。一般应评价的项目包括细胞毒性、致敏和皮内反应等。
吻合钉目前多采用钛、钛合金或纯钽材料。制成吻合钉的纯钛、钛合金材料应符合GB/T 13810中钛或钛合金材料的化学成分要求;制成吻合钉的纯钽材料应符合ISO 13782中纯钽材料(Tal)的化学成分要求。选用表面改性处理的纯钛、钛合金、纯钽或其他材料,应按照GB/T 16886《医疗器械生物学评价》系列标准对吻合钉进行生物相容性评价研究,一般包括但不限于细胞毒性、致敏、皮内反应、急性毒性、亚慢性毒性、遗传毒性和植入后局部反应。
3.灭菌工艺研究
(1)应明确灭菌工艺(方法和参数)及其选择依据和无菌保证水平(SAL),并提供灭菌确认报告。吻合器的无菌保证水平(SAL)应达到1×10—6。
(2)对于可重复使用的吻合器,应当明确推荐的灭菌工艺(方法和参数)及推荐灭菌方法的确定依据,提供器械对所推荐灭菌方法耐受性的研究资料。
(3)残留毒性:若灭菌使用的方法容易出现残留,如环氧乙烷灭菌,应当明确残留物信息及采取的处理方法,并提供研究资料。
4.医疗器械产品注册证申办产品有效期和包装研究
产品货架有效期是指产品在一定的温度、湿度、光线等条件的影响下保持其物理、化学、生物学和微生物学性质的期限。有效期的研究应贯穿于产品研究与开发的全过程,在产品上市后还应继续进行有效期的研究。
货架有效期包括产品有效期和包装有效期。货架有效期验证可采用加速老化或实时老化的研究,实时老化的研究是唯一能够反映产品在规定储存条件下实际稳定性要求的方法。对于包装的有效期验证,建议申请者提交在选择恰当的材料和包装形式,并检测合格后的最终成品包装的初始完整性和维持完整性的检测结果。
在进行加速老化试验研究时应注意:产品选择的环境条件的老化机制应与宣称的贮存、运输环境条件下产品老化的机制相匹配,不应相背离。加速老化研究报告中应明确试验温度、湿度、加速老化时间的确定依据。
产品包装验证可依据有关国内、国际标准进行(如GB/T 19633.1、GB/T 19633.2、ASTM D4169等),提交产品的包装验证报告。包装材料的选择应至少考虑以下因素:包装材料的物理化学性能;包装材料的毒理学特性;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能提供的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求(如无菌开启)的适应性;包装材料与标签系统的适应性;包装材料与贮存运输过程的适合性。其包装验证的资料内容应与包装说明中给出的信息相符。
医疗器械注册咨询吻合器与组件分开包装的,应分别对其有效期和包装进行研究。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服