
医疗器械一次性使用球囊子宫支架产品注册标准及技术要求
医疗器械注册 一次性使用球囊子宫支架产品在《医疗器械分类目录》(2017年第104号)中妇产科治疗器械,该产品分类编码为18-04,管理类别为Ⅱ类,属于无源医疗器械。 产品名称应使用通用名称,并符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第
医疗器械注册一次性使用球囊子宫支架产品在《医疗器械分类目录》(2017年第104号)中妇产科治疗器械,该产品分类编码为18-04,管理类别为Ⅱ类,属于无源医疗器械。
产品名称应使用通用名称,并符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)的要求,如:球囊子宫支架、一次性使用球囊子宫支架 、一次性使用三角球囊子宫支架。
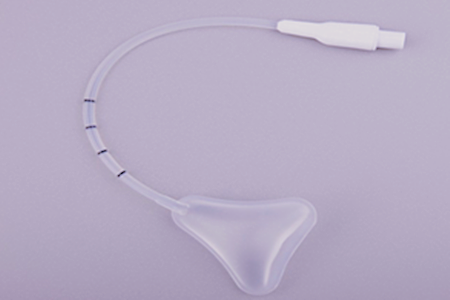
产品的结构和组成:球囊子宫支架一般由导管、球囊、导管座、充盈阀、球囊充起器/注射器(选配)组成。产品主要组件(导管、球囊、导管座)材质一般为硅橡胶材料。该产品以无菌形式提供,一次性使用。
产品工作原理:宫腔手术后,把球囊子宫支架放入宫腔,然后将液体通过充盈阀注入球囊,通过球囊机械压迫作用达到减少子宫出血的目的。
医疗器械产品注册单元划分的原则和实例,按照《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)第七十四条的要求,“原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据”实施。同时可参考总局《医疗器械注册单元划分指导原则》(食药总局通告2017年第187号)。
表1 相关产品标准
| 标准编号 | 标准名称 |
| GB 15810-2001 | 《一次性使用无菌注射器》 |
| GB 18279.1-2015 | 《医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》 |
| GB/T 18279.2-2015 | 《医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南》 |
| GB 18280.1-2015 | 《医疗保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》 |
| GB 18280.2-2015 | 《医疗保健产品灭菌 辐射 第2部分:建立灭菌剂量 》 |
| GB/T 18280.3-2015 | 《医疗保健产品灭菌 辐射 第3部分:剂量测量指南 》 |
| GB/T 191-2008 | 《包装储运图示标志》 |
| GB/T 1962.1-2015 | 《注射器、注射针及其他医疗器械用6%(鲁尔)圆锥接头 第1部分:通用要求》 |
| GB/T 2828.1-2012 | 《计数抽样检验程序 第1部分 按接收质量限(AQL)检索的逐批检验抽样计划》 |
| GB/T 2829-2002 | 《周期检验计数程序及表(适用于对过程检验稳定的检验)》 |
| GB/T 14233.1-2008 | 《医用输液、输血、注射器具检验方法第1部分:化学试验方法》 |
| GB/T 14233.2-2005 | 《医用输液、输血、注射器具检验方法 第2部分:生物学试验方法》 |
| GB/T 15812.1-2005 | 《非血管内导管 第1部分:一般性能试验方法》 |
| GB/T 16886.1-2011 | 《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》 |
| GB/T 16886.5-2017 | 《医疗器械生物学评价 第5部分:体外细胞毒性试验》 |
| GB/T 16886.10-2017 | 《医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验》 |
| GB/T 19633.1-2015 | 《最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求》 |
| GB/T 19633.2-2015 | 《最终灭菌医疗器械包装 第2部分:成形、密封和装配过程的确认的要求》 |
| YY 0285.4-2017 | 《血管内导管一次性使用无菌导管第4部分:球囊扩张导管》 |
| YY 0285.1-2017 | 《血管内导管一次性使用无菌导管第1部分:通用要求》 |
| YY 0325-2016 | 《一次性使用无菌导尿管》 |
| YY/T 0313-2014 | 《医用高分子产品 包装和制造商提供信息的要求》 |
| YY/T 0316-2016 | 《医疗器械 风险管理对医疗器械的应用》 |
| YY/T 0466.1-2016 | 《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》 |
| YY/T 0681.1-2009 | 《无菌医疗器械包装试验方法 第1部分:加速老化试验指南》 |
| YY 0334-2002 | 硅橡胶外科植入物通用要求 |
| YY 0817-2010 | 带定位球囊的肠营养导管物理性能要求及实验方法 |
| 《中华人民共和国药典》(2015版) |
上述标准包括了产品技术要求中经常涉及到的标准。医疗器械注册办理企业还应根据产品的特点引用涉及到的其他行业外的标准或特殊标准。在对产品适用及引用标准审查时,首先对引用标准的齐全性和适宜性进行审查,也就是在编写产品技术要求时是否准确参考了与产品相关的国家、行业标准。其次,应注意标准编号、标准名称是否完整规范,年代号是否有效。一般来说,产品技术要求应不低于相应的国家标准及行业标准。
如有新版强制性国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行业标准。
医疗器械产品技术要求
医疗器械注册代理应包括的主要性能指标根据《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)的要求,产品技术要求应符合国家标准、行业标准和有关法律、法规的要求。在此基础上,申请人应根据产品的特点制定保证产品安全有效、质量可控的技术要求。产品技术要求及试验方法均应经过验证。常见的技术指标包括以下几点(不限于此):
1.外观与尺寸
1.1 产品外表面应光滑、无毛刺、清洁、无加工缺陷。刻度应清晰可见。
1.2 导管直径、长度、球囊尺寸、容积等应符合设计要求。有效长度L为测量从球囊头端延伸至导管和座的连接处(详见图2)。
2.物理性能
2.1导管及连接部位应具有一定的抗断裂强度,如:应能承受大于等于15N轴向静拉力。
2.2球囊可靠性
当球囊按照标称体积1.5倍充起时,并在37.0±2℃的环境中放置 24h 后,球囊、充起管路及接头均无无泄漏和损坏。
2.3球囊回缩性能
球囊按照标称体积充盈,置于37±2℃环境中24小时后,球囊应能有效缩回(建议参考YY 0325-2016附录D球囊液体回收率制定)。
2.4耐弯曲性能
手持软管两标线处弯曲软管,使软管两标线相触,并使标线外1cm长软管平行接触。医疗器械产品注册代办试验长度内不发生打折(建议参考GBT15812-1995中耐弯曲试验部分制定)。球囊未充盈前折叠后,能充盈张开。
2.5充盈阀的可靠性
对充盈阀的可靠性应提出以下要求:
2.5.1充盈阀圆锥接头应符合GB/T 1962.1的规定,与符合GB/T 1962.1的外圆锥接头配合良好,无明显的摆动。
2.5.2充盈阀应该开合良好,无漏液现象。
2.5.3当抽出球囊内的液体时,充盈阀不应该阻碍球囊放水。
2.6若含有球囊充起组件,应制定相应的性能指标。如:含有充起球囊的注射器,应参考GB15810中适用部分(如:5.1-5.10)制定相应性能指标。
3.化学性能
医疗器械注册代办根据产品材料特性,由企业决定对化学性能,如:重金属、酸碱度、还原物质(易氧化物)、紫外吸光度、蒸发残渣、过氧化物等提出要求。若灭菌使用的方法容易产生残留,应明确残留物的名称及残留量。
注意:化学性能检验方法中应明确样品的制备方法,样品检验液的制备应符合GB/T14233.1第四部分的要求。
4.生物性能
如:无菌、细菌内毒素等。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册代理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服