
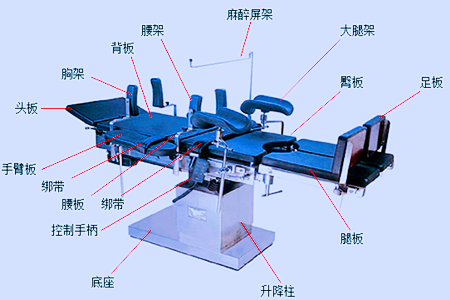
医疗器械注册电动手术台由床体(包括支撑部分、传动部分和控制部分)和附件组成。支撑部分、传动部分和控制部分及附件需要根据不同生产厂家产品的具体情况予以确定。一般情况下,支撑部分主要包括台面、升降柱、底座三部分,其中台面可由多块不同功能的支撑板组成,如:头板、背板、腰板、腿板、臀板、足板、延长板等,底座部分一般包括脚轮和刹车锁定装置。传动部分按各部件的运动形式一般可分为电动驱动部分和手动驱动部分两种,其中电动驱动部分一般分为液压驱动和机械驱动,手动驱动部分一般分为手动机械结构和气动结构。液压驱动结构一般包括油缸、油泵、电磁阀、溢流阀、输油管路、液压筒等;机械驱动结构一般包括电机、蜗轮、蜗杆、齿轮等;气动结构一般包括自锁式气弹簧等。控制部分主要包括控制手柄(有线/无线)、控制面板、脚踏开关等。
医疗器械产品注册申请产品在产品结构组成中,应能体现出各型号产品的具体结构组成。产品结构组成示例:该产品由床体(包括支撑部分、传动部分和控制部分)和附件组成。某型产品由台面(头板、背板、腿板、臀板、足板)、升降柱、底座、液压传动系统、线控手柄、脚踏控制器及附件(手臂板、麻醉屏架、胸架、腰架、大腿架、绑带)组成;某型产品由台面(头板、背板、腿板)、升降柱、底座、液压传动系统、线控手柄及附件(手臂板、麻醉屏架、大腿架、绑带)组成。
医疗器械注册代理《医疗器械分类目录》和《电动手术台》(YY/T 1106-2008)中涉及的电动手术台产品,编码代号为6854。产品名称应符合《医疗器械通用名称命名规则》的要求,可直接采用《医疗器械分类目录》或行业标准YY/T 1106-2008《电动手术台》上的通用名称—电动手术台。产品的名称中可以体现出具体的传动方式,如:电动液压手术台等;仅有单一临床用途的产品,可在产品名称前冠以适用范围的限定词,如:眼科电动手术台、脑外科电动液压手术台等。
医疗器械注册代办电动手术台产品注册申请产品的四大研究资料要求:
一、产品性能研究
功能性指标的验证应根据综述资料中有关申报产品结构组成的情况,可参考YY/T 1106-2008的要求,至少应包括以下指标:基本参数、渗漏(若适用)、动作平稳性、台面摆动量、装卸方便性、X射线透过性(若适用)、控制器按键功能。如有附件,应根据不同附件的具体情况做出相应要求,如:延长板的连接性能、承重性能等。
医疗器械产品注册代理安全性指标的验证包括电气安全指标和电磁兼容指标两大类。电气安全指标应当包括GB 9706.1-2007和YY 0570-2013及其他适用的国家标准和行业标准中的所有指标,电磁兼容指标应当包括YY 0505-2012及其他适用的国家标准和行业标准中的所有指标。
研究资料中应详细写明通过研究验证确定的电动手术台产品的结构组成、基本尺寸、附件信息及相关要求等。
二、软件研究
参见《医疗器械软件注册申报资料指导原则》的相关要求。
三、消毒方法研究
医疗器械注册办理申请人应对说明书中推荐使用的消毒方法进行研究,给出消毒方法研究报告。
若注册申请人所推荐的消毒方法为临床通用消毒方法,则应提供此种消毒方法的来源及确定依据,并验证推荐的消毒方法对产品的影响;
若注册申请人所推荐的消毒方法为自行规定的方法,则应对此种方法的消毒效果进行研究,并验证推荐的消毒方法对产品的影响。
四、产品使用期限和包装研究
医疗器械产品注册代办产品使用期限研究:注册申请人应根据自身产品临床应用和产品设计情况,确定出产品的关键部件和可更换部件。注册申请人应明确在预期使用条件下关键部件的使用期限,及可更换部件的定期保养维护时间和更换频次,且应提供确定使用期限和更换频次的理轮依据。若关键部件也可更换时,也应说明其定期保养维护时间和更换频次。电动手术台产品中的关键部件至少包括电机、液压泵(如适用)。
医疗器械产品注册办理包装研究:注册申请人应明确产品包装材料、包装清单;提供在宣称的运输条件下,符合GB/T14710-2009中运输试验要求的验证资料;并提供在宣称贮存条件下,保持包装完整性的依据。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、同类产品对比免临床评价资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服