
医疗器械注册证申请肠内营养泵产品名称要求按照《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)和国家标准、行业标准中的通用名称要求,如:肠内营养泵。按照《医疗器械分类目录》(2017年第104号公告)注输、护理和防护器械中的肠内营养泵,按第二类医疗器械管理,类别代号为14-03-01。
医疗器械注册证办理产品的结构和组成:
肠内营养泵总体结构的详细描述,应包括所有组成部分,并给出有标记的图示(如图表、照片和图纸),图示应清楚地标识关键部件/组件,并对这些部件进行详细的说明以方便理解这些图示,例如:
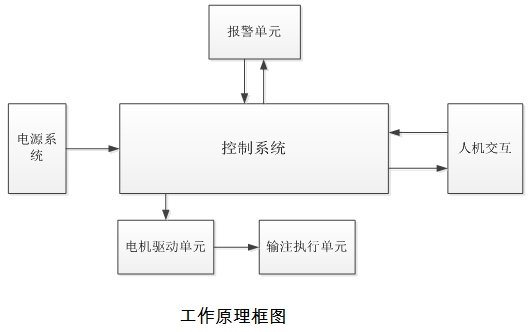
肠内营养泵通常由以下但不限于以下部分组成:电源系统、控制系统、电机驱动单元、输注执行单元、检测单元、报警单元、人机交互单元、外壳。
电源系统:为肠内营养泵提供工作电源。
控制系统:是肠内营养泵进行智能控制和管理的核心单元,其对检测信号进行处理,并根据处理结果下达指令,以保证肠内营养泵的安全有效运行。
电机驱动单元:接受控制系统的转速和位置等指令,驱动电机按照指定的转速及转向工作。
输注执行单元:产生一正压作用于输入管路,推动并控制营养液流入患者体内。
检测单元:其作用是将检测到的信号进行处理后传输至控制系统。
报警单元:其响应控制系统发出的报警指令,发出声光报警。
人机交互单元:包括输入装置和显示装置。
壳体结构:是肠内营养泵各系统的安装载体和外部防护,同时对于电击和电磁干扰提供必要的隔离保护措施。
产品结构组成中不包含输注管路,但生产企业应在产品研究资料及说明书等相关注册申报资料中详细说明配套输注管路的具体要求。
肠内营养泵产品工作原理/作用机理:
医疗器械产品注册证申请人应具体描述产品的工作原理。
1.工作原理的描述: 肠内营养泵是通过泵产生的正压推动并控制营养液流入患者体内,实现的方式包括但不限于以下三种,应确定产品采用哪种方式;
(1)线性蠕动挤压结构将电机的转动转化成泵片的直线往复运动,多个泵片依序的往复运动以推动输注管路中的液体定向流动;
(2)盘式蠕动挤压结构由电机通过减速机构带动转盘运动,推动输注管路中的液体流动;
(3)推注式结构经减速机构驱动丝杆、螺母,将电机的旋转运动转化为螺母的直线运动,螺母与配套注射器的推杆相连,即可推动配套注射器的活塞进行注射输注。
2.医疗器械产品注册证办理产品工作原理框图
肠内营养泵的常用工作原理框图如下:
| 标准编号 | 标准名称 |
| GB/T 191-2008 | 包装储运图示标志 |
| GB/T 5465.2-2008 | 电气设备用图形符号 第2部分:图形符号 |
| GB/T 9969-2008 | 工业产品使用说明书 总则 |
| GB 9706.1-2007 | 医用电气设备 第1部分:安全通用要求 |
| GB/T 14710-2009 | 医用电器环境要求及试验方法 |
| YY/T 0316-2016 | 医疗器械风险管理对医疗器械的应用 |
| YY 0505-2012 | 医用电气设备第1-2部分:安全通用要求 并列标准:电磁兼容要求和试验 |
| YY 0709-2009 | 医用电气设备第1-8部分:安全通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南 |
肠内营养泵产品的适用范围/预期用途/禁忌症
医疗器械产品注册证代办注册申请人应描述肠内营养泵产品的适用范围,包括适用人群(如成人、婴幼儿或某一类疾患病人等)、适用环境(如医疗机构、急救、特殊环境)、输注途径(胃肠道)。
禁忌症:不能用于静脉通道输注应在禁忌症中明确,若还有其它禁忌症、例如:肠梗阻、胃肠穿孔、上消化道出血、严重吸收不良综合症、腹腔内感染等应一并列出。
产品的适用范围应与申报产品的性能、功能相符,并与临床评价资料结论一致。
肠内营养泵产品的临床评价要求:
医疗器械注册证代理肠内营养泵注册申请肠内营养泵已列入免于进行临床试验医疗器械目录(国家药品监督管理局通告2018年第94号,以下简称《目录》),可按《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)的豁免临床的要求提交临床评价资料。提交的上述资料应能证明申报产品与《目录》所述的产品具有等同性。若无法证明申报产品与《目录》产品具有等同性,则应按照该指导原则其他要求开展相应工作。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服