
医疗器械产品注册吻(缝)合器产品注册技术要求编写方案根据《吻(缝)合器注册技术审查指导原则(2018年修订)》,吻合器需要考虑的基本技术性能指标,其中对产品的技术要求主要参照YY/T 0245—2008《吻(缝)合器 通用技术条件》、YY 0875—2013《直线型吻合器及组件》、YY 0876—2013《直线型切割吻合器及组件》。此外企业可参考相应的国家标准、行业标准,根据企业自身产品的技术特点制定相应的要求。以下如有不适用条款(包括国家标准、行业标准要求),企业应在产品注册资料中加以说明。
1.材料
医疗器械注册应明确参照YY/T 0245—2008《吻(缝)合器 通用技术条件》、YY 0875—2013《直线型吻合器及组件》、YY 0876—2013《直线型切割吻合器及组件》或相关国家标准、行业标准要求写出吻合器的全部制作材料及其材料标准(包括吻合钉)。
2.灵活性
(1)吻合器开闭应灵活,不应有卡滞现象
(2)吻合器的组件与器身架应能顺利地装配和拆卸;各移动部位应能顺利推动,不得有卡住、松动现象;组件装入器身应牢固,吻合钉不得脱落变形。
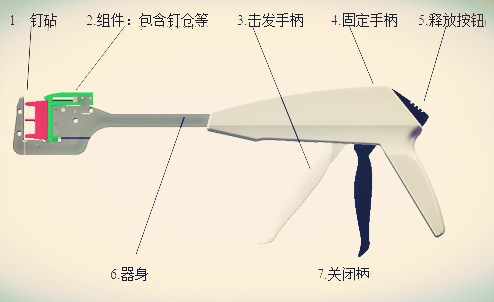
(3)吻合器的保障机构(释放钮、关闭柄)开闭应灵活,使用应安全。弹簧应有足够弹性,当松开手柄时能迅速复位。
3.装配性
(1)吻合器组件更换应方便、定位可靠。
(3)组件经甩动后吻合钉不应露出钉仓表面。
4.锋利度
(1)直线型切割刀刃口应锋利,切割力应不大于0.80N。
(2)环形刀刃口应锋利,当切割3—0真丝捻制不涂层缝合线时,其切割力应不大于1.6N。
5.医疗器械注册办理吻合和切割功能
(1)管型吻合器应有良好的吻合和切割性能,能按申请人规定要求成型,吻合钉应成类“B”字形,无不良成型现象;环形刀不得有卷刃、崩刃,能切割试验材料,且切割边缘应整齐,无毛边。
(2)线型切割吻合器应具有良好的吻合和切割性能,更换组件,作不少于5次切割吻合,其每次吻合后的缝钉应成类“B”字形。
(3)吻合后的切割边缘应整齐,无毛边。
(4)线型切割吻合器每次吻合线长度比切割线长度至少长1.5倍钉长。
6.吻合口的耐压性能
经吻合器缝合后的缝合口应能承受不小于3.6kPa的压力,在15s内漏水不超过10滴。
7.吻合器应具有空钉仓保护装置,并保持其可靠性。
8.硬度
重复使用的抵钉座的硬度应不小于35 HRC。采用20Cr13材料制成的部件应经热处理,其硬度为40HRC—48HRC;切割刀的硬度应不低于377HV0.2。(医疗器械产品注册办理申请人也可根据自己产品的性能制定部件和切割刀的硬度,但是需要提供完整的验证资料予以证明)。
9.表面粗糙度:吻合器外露金属表面粗糙度Ra≤0.8μm。
10.耐腐蚀性能:重复性使用吻合器切割刀、抵钉座的耐腐蚀性能应符合YY/T 0149中5.4b级的规定
11.包装密封
(1)一次性使用吻合器及组件的包装应密封完好。
(2)一次性使用吻合器及组件的包装封口剥离强度不小于0.10 N/mm。剥离后两接触表面应光滑且连续均匀,无分层或撕裂现象。
12.外观
(1)吻合器外表光滑、轮廓清晰、无毛刺、划伤、锈迹等缺陷。
(2)吻合器外表面上的字迹、标志清晰,不得有错位、歪斜等缺陷。
(3)吻合钉钉头应尖锐,表面不得有毛刺、飞边等缺陷;切割刀应锋利,不得有卷刃、崩刃。
13.尺寸
医疗器械注册代理注册吻合器产品的尺寸应符合产品技术要求中的规定。
14.灭菌:
(1)一次性使用吻合器及组件经已确认过的灭菌过程进行灭菌,产品应无菌。
(2)如采用环氧乙烷灭菌,一次性使用吻合器及组件的环氧乙烷残留量应不大于10 μg/g。
15.生物学评价
(1)吻合钉,选用表面作改性处理(包括表面涂层、酸蚀及其他表面处理)的纯钛、钛合金材料和纯钽材料制成的吻合钉的生物学评价应符合GB/T 16886.1的规定。
(2)吻合器及组件的细胞毒性应不大于1级。
(3)吻合器及组件迟发型超敏反应的等级应不大于1。
(4)吻合器及组件皮内反应的计分应不大于1。
16.医疗器械注册代办吻合器附件(若有)要求:应分别列出附件的材料、尺寸、性能要求;此外根据不同材料特性,由企业决定是否对吻合器及组件的化学性能提出要求。
深圳鸿远医疗器械咨询服务公司是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册代办理咨询、代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、医疗器械广告批文申报等提供一站式的服务机构,欢迎您咨询与合作!

 在线客服
在线客服