
医疗器械注册中央监护软件的产品技术要求参照《医疗器械软件注册技术审查指导原则》(国家食品药品监督管理总局通告2015年第50号)附录I。申请人可以在此基础上根据产品自身技术特点制定相应的性能指标,同时应在研究资料中详述相关标准不适用条款的理由。
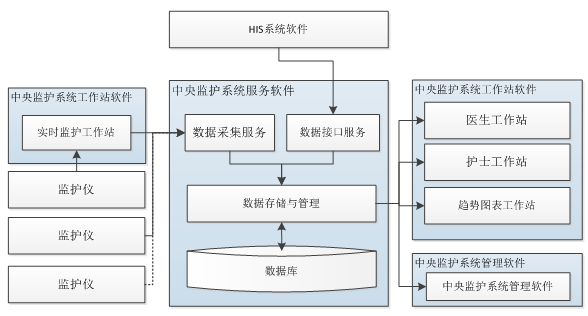
附录I医疗器械产品注册技术要求中性能指标的下列条款需要说明:
2. 性能指标
2.1 通用要求
2.1.1 处理对象
明确软件的处理对象类型、数据(如心电(ECG)、呼吸(RESP)、体温(TEMP)、脉搏血氧饱和度(SpO2)、脉搏率(PR)、无创血压(NIBP)、产科胎心率及宫缩压力、脑电图、有创血压等)。
2.1.2 最大并发数
明确软件的最大并发设备数。
2.1.3 数据接口
明确软件的通用数据接口(如Dicom、HL7)、产品接口(可联合使用的独立软件、医疗器械硬件)。
2.1.4 特定软硬件
明确软件完成预期用途所必备的独立软件、医疗器械硬件。
2.1.5 临床功能
医疗器械产品注册代办依据说明书明确软件全部临床功能纲要(注明可选)。
2.1.6 使用限制
依据说明书明确软件的使用限制。
2.1.7 用户访问控制
明确软件的用户访问控制管理机制。
2.1.8 版权保护
明确软件的版权保护技术。
2.1.9 用户界面
明确软件的用户界面类型。
2.1.10 消息
明确软件的消息类型。
2.1.11 可靠性
医疗器械注册代办明确软件出错后数据保存与恢复能力。明确数据传输后数据的一致性和完整性。
2.1.12 维护性
明确软件向用户提供的维护信息类型。
2.1.13 效率
明确软件在典型配置条件下完成典型临床功能所需的时间,如:明确在指定测试条件下传输数据的时间,测试条件应明确网络环境以及硬件配置。
2.1.14 运行环境
明确软件运行所需的硬件配置、软件环境和网络条件,包括服务器(如适用)和客户端的要求。
2.2 质量要求
医疗器械注册代理符合GB/T 25000.51中相关要求。
2.3 专用要求 (如适用)
如果中央监护软件能够判断、形成报警信息并执行报警(而不是仅从床旁监护仪获得报警信号),应符合YY 0668—2008的51条款(危险输出的防止)。
如果中央监护软件能够显示心电波形,应符合YY 1079—2008的4.2.8条款(对具有心电图波形显示能力的监护仪的特殊要求)。
2.4 安全要求
医疗器械产品注册代理中央监护软件安全要求应符合YY 0709的要求。
深圳鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询机构,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、医疗器械广告批文申报等提供一站式的服务机构,欢迎您咨询与合作!

 在线客服
在线客服