
医疗器械咨询据广东省药监局2018年9月18日发布《广东省第二、三类医疗器械委托生产备案》办理流程指南具体要求如下:
二、三类医疗器械委托生产备案办理受理条件
(1)持有本企业的《医疗器械注册证》
(2)医疗器械委托生产的委托方应当是委托生产医疗器械的境内注册人或者备案人。其中,委托生产不属于按照创新医疗器械特别审批程序审批的境内医疗器械的,委托方应当取得委托生产医疗器械的生产许可。
(3)医疗器械委托生产的受托方应当是取得受托生产医疗器械相应生产范围的生产许可的境内生产企业。受托方对受托生产医疗器械的质量负相应责任。
(4)委托方应当向受托方提供委托生产医疗器械的质量管理体系文件和经注册或者备案的产品技术要求,对受托方的生产条件、技术水平和质量管理能力进行评估,确认受托方具有受托生产的条件和能力,并对生产过程和质量控制进行指导和监督。
(5)受托方应当按照医疗器械生产质量管理规范、强制性标准、产品技术要求和委托生产合同组织生产,并保存所有受托生产文件和记录。
(6)委托方和受托方应当签署委托生产合同,明确双方的权利、义务和责任。
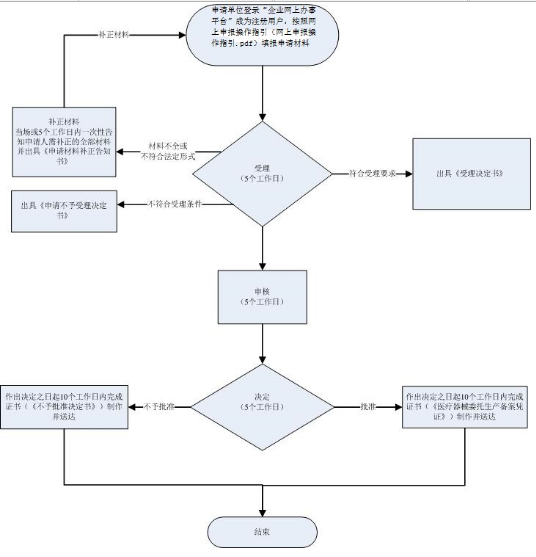
1.申请
申请人通过网上方式提出申请,根据申请材料的要求提交申请材料。
(1)申报人必须通过我局的企业网上办事平台或者省政务服务网进行申报工作,如需补充纸质材料(如无法上传的图纸等特殊格式文件),请于网上申报完成后直接网上提交申请。
(2)接收部门:广东省食品药品监督管理局业务受理处。
(3)网上申报不限时间,业务受理处办公时间:每周一至周五
2.受理
办理机关收到申请材料之日起在5个工作日内作出受理或不予受理决定。
经审查,材料不全或不符合法定形式的,办理机关应在5个工作日内一次性告知申请人需补正的全部内容。
3.获取办理结果
实施机关决定予以批准的,申请人可获得《医疗器械委托生产备案表》。
实施机关决定不予批准的,申请人可获得《不予批准决定书》,《不予批准决定书》中应说明不予批准的理由。
实施机关自作出审批决定之日起10个工作日内在网上公开办理结果,并告知申请人。
广东省局提供办理结果免费邮寄服务,申请人无需到我局受理大厅领取
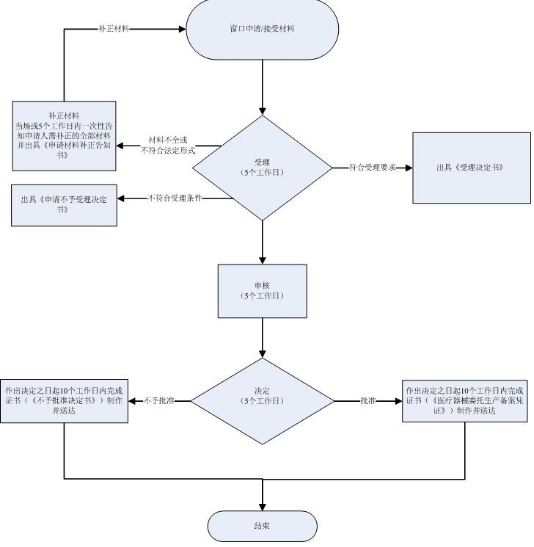
1.申请
申请人通过网上方式提出申请,根据申请材料的要求提交申请材料。
(1)申报人必须通过我局的企业网上办事平台或者省政务服务网进行申报工作,如需补充纸质材料(如无法上传的图纸等特殊格式文件),请于网上申报完成后5个工作日内寄达省局业务受理处,或抵达省局业务受理处进行递交。
(2)接收部门:广东省食品药品监督管理局业务受理处。
(3)网上申报不限时间,业务受理处办公时间:每周一至周五
2.受理
办理机关收到申请材料之日起在5个工作日内作出受理或不予受理决定。
经审查,材料不全或不符合法定形式的,办理机关应在5个工作日内一次性告知申请人需补正的全部内容。
3.获取办理结果
实施机关决定予以批准的,申请人可获得《医疗器械委托生产备案表》。
实施机关决定不予批准的,申请人可获得《不予批准决定书》,《不予批准决定书》中应说明不予批准的理由。
实施机关自作出审批决定之日起10个工作日内在网上公开办理结果,并告知申请人。申请人可选择自取或者邮寄送达的方式取得办理结果。
广东省局提供办理结果免费邮寄服务,申请人无需到我局受理大厅领取。
第二、三类医疗器械委托生产备案申请材料
1、《医疗器械委托生产备案表》
2、委托生产医疗器械的注册证复印件;委托生产不属于按照创新医疗器特别审批程序审批的境内医疗器械的,还应当提交委托方的医疗器械生产许可证复印件;属于按照创新医疗器械特别审批程序审批的境内医疗器械的,应当提交创新医疗器械特别审批证明资料。
3、委托方和受托方企业营业执照和组织机构代码证复印件复印件
4、受托方的《医疗器械生产许可证》
5、委托生产合同复印件
6、申请材料真实性的自我保证声明,包括申请材料目录和企业对材料作出如有虚假乘担法律责任的承诺。
7、凡申请企业申报材料时,办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》。
第二、三类医疗器械委托生产备案设定依据:《医疗器械生产监督管理办法》
1、医疗器械委托生产的委托方应当是委托生产医疗器械的境内注册人或者备案人。其中,委托生产不属于按照创新医疗器械特别审批程序审批的境内医疗器械的,委托方应当取得委托生产医疗器械的生产许可或者办理第一类医疗器械生产备案。
医疗器械委托生产的受托方应当是取得受托生产医疗器械相应生产范围的生产许可或者办理第一类医疗器械生产备案的境内生产企业。受托方对受托生产医疗器械的质量负相应责任。
2、委托方在同一时期只能将同一医疗器械产品委托一家医疗器械生产企业(绝对控股企业除外)进行生产。
3、具有高风险的植入性医疗器械不得委托生产,具体目录由国家食品药品监督管理总局制定、调整并公布。
4、 委托生产第二类、第三类医疗器械的,委托方应当向所在地省、自治区、直辖市食品药品监督管理部门办理委托生产备案;委托生产第一类医疗器械的,委托方应当向所在地设区的市级食品药品监督管理部门办理委托生产备案。符合规定条件的,食品药品监督管理部门应当发给医疗器械委托生产备案凭证。
备案时应当提交以下资料:
(一)委托生产医疗器械的注册证或者备案凭证复印件;
(二)委托方和受托方企业营业执照复印件;
(三)受托方的《医疗器械生产许可证》或者第一类医疗器械生产备案凭证复印件;
(四)委托生产合同复印件;
(五)经办人授权证明。
医疗器械生产许可证代办,委托生产不属于按照创新医疗器械特别审批程序审批的境内医疗器械的,还应当提交委托方的《医疗器械生产许可证》或者第一类医疗器械生产备案凭证复印件;属于按照创新医疗器械特别审批程序审批的境内医疗器械的,应当提交创新医疗器械特别审批证明资料。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、医疗器械广告批文申报等提供一站式的服务机构,欢迎您咨询与合作!

 在线客服
在线客服