
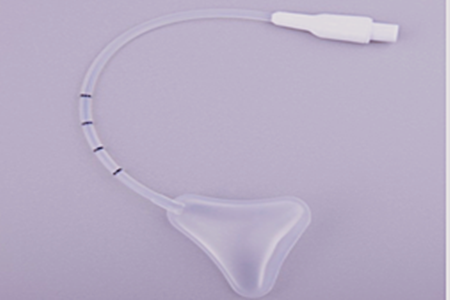
医疗器械一次性使用球囊子宫支架产品注册临床评价细化要求,根据国家食品药品监督管理总局《新修订免于进行临床试验医疗器械目录的通告》(2018年第94号)中775中规定:18子目录下Ⅱ类无源产品均免于进行临床试验。产品与已获准境内注册产品具有等同性,产品组成材料成熟。新型结构设计、新型作用机理、药械组合产品除外。球囊子宫支架基本符合18-04妇产科治疗器械产品描述,若申请注册产品与已上市产品具有等同性,可按免临床目录途径提交临床评价资料。如申报产品使用了新材料、新工艺、采用了新型作用机理、出现了新的结构设计,应按照《医疗器械临床评价技术指导原则》其他途径提交临床评价资料。
对于列入《免于进行临床试验的医疗器械目录》产品,注册申请人需提交申报产品相关信息与《目录》所述内容的对比资料和申报产品与已获准境内注册的《目录》中医疗器械的对比说明。具体需提交的临床评价资料要求如下:
1)提交申报产品相关信息与《目录》所述内容的对比资料;
2)提交申报产品与《目录》中已获准境内注册医疗器械的对比说明,对比说明应当包括《申报产品与目录中已获准境内注册医疗器械对比表》(见医疗器械临床评价技术指导原则附件1)和相应支持性资料。
医疗器械临床试验提交的上述资料应能证明申报产品与《目录》所述的产品具有等同性。若无法证明申报产品与《目录》产品具有等同性,则应按照《医疗器械临床评价技术指导原则》其他要求开展相应工作。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服