
美国FDA公布了2019财年医疗器械使用费的费率和付款程序。费率适用于2018年10月1日至2019年9月30日。用户费用包括医疗设备提交以及某些定期报告和医疗器械FDA注册企业的年费。
通过提交小型企业认证请求,小型企业可以有资格支付降低的费用,而不是标准费用。
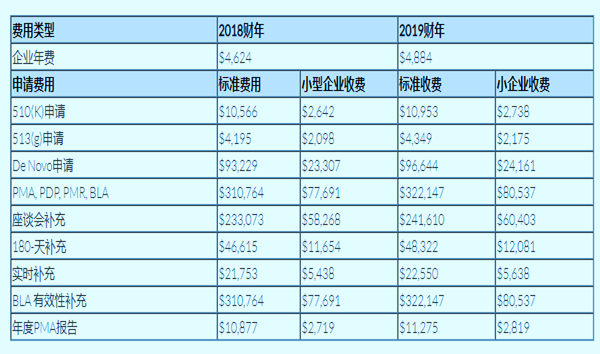
MDUFA要求所有向FDA注册的医疗器械企业在每年注册更新期间缴纳官方费用。2019财年所有的企业官方费用为4,884美元。根据MDUFA的法规规定,对于没有缴纳该官方费用的企业,FDA将不会承认其注册的合法性。
此外,MDUFA还规定递交某些特定的医疗器械申请,亦需向FDA缴纳费用。小型企业,即MDUFA定义为最近一个税收年度的贸易总额或收款额不超过一亿美元的企业,可以按照小企业收费标准缴纳费用。所有的医疗器械申请费较去年同比上涨3-4%。
您可以查看下方2018财年和2019财年的MDUFA费用对比图:
2018财年,所有注册类别的FDA用户费用均有所增加。
设备使用费最初是由医疗器械使用费和现代化法案(MDUFMA)于2002年制定的。用户费用于2007年,2012年和2017年根据FDA再授权法案(MDUFA IV)的医疗器械使用者费用修订续订。MDUFA IV将于2017年10月1日至2022年9月30日期间实施。
FDA表示,收取费用的目的是减少将安全有效的医疗设备带入美国市场所需的时间。
鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服